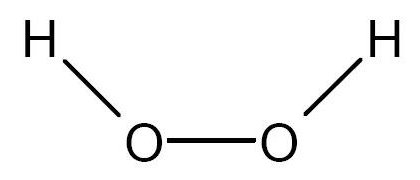
Superoxido
Un superóxido o hiperóxido es un anión con fórmula O2 Se
considera que el oxígeno, el cual siempre tiene estado de oxidación −2 tiene un
estado de oxidación de −1/2, se caracterizan por la
presencia del anión dióxido(1–), diatómico, mientras que en los ozónidos
aparece el anión trióxido(1–), triatómico.
En ambos casos se pueden aplicar las mismas estrategias de
formulación y nomenclatura mencionadas anteriormente, por lo que nos
limitaremos a exponer algunos ejemplos:
Superoxidos Ionicos
Los superóxidos iónicos, MO2, se forman por interacción de
O2 con K, Rb o Cs, como sólidos cuyo color va del amarillo al naranja. El NaO2
puede obtenerse solo por reacción del Na2O2 con O2 a 300 atm y 500 °C (Na2O2+O2→2NaO2). El LiO2 no ha podido aislarse. Los superóxidos de los
alcalinotérreos, Mg, Zn y Cd se presentan solo en pequeñas concentraciones como
disoluciones sólidas en los peróxidos. El ion O2− posee un electrón
desapareado. Los superóxidos son agentes oxidantes muy poderosos. Reaccionan
vigorosamente con el agua.
 |
| SUPEROXIDO DE POTASIO |
Oxido Acido
Óxido es la
denominación genérica de un compuesto binario formado por oxígeno y cualquier
otro elemento químico de la tabla periódica.
Un óxido ácido, u
óxido no metálico, es un compuesto químico binario que resulta de la
combinación de un elemento no metálico con el oxígeno. Por ejemplo, el carbono
(presente en la materia orgánica) se combina con el dioxígeno del aire para
formar dióxido de carbono y monóxido de carbono, a través de la combustión.
Otro ejemplo es la formación del dióxido de azufre por la combustión del azufre
contenido en productos derivados del petróleo.
Los óxidos ácidos
forman ácidos al reaccionar con el agua, de ahí su nombre. Así, el dióxido de
carbono con el agua forma ácido carbónico, mientras que el trióxido de azufre
forma ácido sulfúrico. Los ácidos producidos a partir de los óxidos no
metálicos con agua se denominan oxácidos, debido a que contienen oxígeno.
Los óxidos ácidos,
son, por lo general, gaseosos y tienen puntos de fusión muy bajos, en
comparación con los óxidos metálicos u óxidos básicos.
Fórmulas moleculares
La suma de los
estados de oxidación de los átomos de una especie química debe ser igual a
cero, para lo cual en un compuesto binario se busca el múltiplo común menor
entre las cargas y se agrega un subíndice por el cual multiplicar la carga para
que sea igual al múltiplo común encontrado.
Según la IUPAC, los
elementos se escriben en la fórmula molecular en orden creciente de
electronegatividad. En este caso, primero se escribe el no metal y luego el
oxígeno.
Como la variación de
la electronegatividad en la tabla periódica de los elementos no sigue un orden
regular, la IUPAC considera, sólo a efectos de nomenclatura de las sustancias,
las siguientes reglas arbitrarias:
Dentro de cada
columna de la tabla periódica se considera que la electronegatividad aumenta de
abajo a arriba.
Un elemento de
cualquier columna de la tabla periódica se considera más electronegativo que
uno de una columna situada más a la izquierda, y menos electronegativo que uno
de una columna situada más a la derecha. Se considera la columna XVIII, la de
los gases nobles, a la izquierda de la columna I, la de los alcalinos.
El hidrógeno se
considera, en este orden arbitrario, de una electronegatividad mayor que la del
nitrógeno (primer elemento de la columna XV) y menor que la del polonio (último
elemento de la columna XVI).
Con estas reglas,
cuando el oxígeno se combine con cualquier elemento que esté a su izquierda o
debajo en la tabla periódica, el oxígeno se escribirá siempre en la fórmula a
la derecha y el otro elemento a la izquierda. Y lo mismo cuando el oxígeno se
combine con el hidrógeno:
Oxido Básico
DEFINICION: Un óxido básico es un compuesto que resulta de la combinación de un elemento metal con el oxígeno.
-Como se forman: Los óxidos básicos se forman con un metal más oxígeno, los óxidos de elementos menos electronegativos tienden a ser básicos. Se les llaman también anhídridos básicos; ya que al agregar agua, pueden formar hidróxidos básicos. Por ejemplo:
-Que características presentan al reaccionar con el agua: Los óxidos básicos al reaccionar con el agua, forman compuestos llamados hidróxido
Oxido Peróxido
 Peróxido es una noción
que se emplea en la química para nombrar al óxido que cuenta con el número más
elevado de oxígeno entre todos los posibles. Puede decirse, por lo tanto, que
un peróxido es un óxido que dispone de un nivel más alto de oxígeno que los
óxidos corrientes.
Peróxido es una noción
que se emplea en la química para nombrar al óxido que cuenta con el número más
elevado de oxígeno entre todos los posibles. Puede decirse, por lo tanto, que
un peróxido es un óxido que dispone de un nivel más alto de oxígeno que los
óxidos corrientes.
La estructura de un
peróxido está dada por un enlace de tipo covalente entre un oxígeno y otro
oxígeno. El oxígeno, en un peróxido, presenta un estado de oxidación equivalente
a -1.
Los peróxidos tienen
la capacidad de provocar estallidos o fuego cuando entablan relación con una
sustancia inflamable. Debido a esta particularidad, el trabajo en un
laboratorio con este tipo de elementos debe ser muy cuidadoso, ya que los accidentes
pueden ser potencialmente letales.
Con peróxidos, es
posible crear productos con la capacidad de desinfectar, combustibles, tinturas
y muchas otras sustancias de gran utilidad a nivel industrial o doméstico,
según el caso.
El peróxido más común
es el peróxido de hidrógeno, denominado popularmente como agua oxigenada
Oxido Doble
Los óxidos dobles son compuesto de:
DOBLE: contiene más de un catión.
Podemos encontrarnos que los dos cationes sean diferentes.
A la hora de formular, recordemos que primero ponemos los cationes y luego los aniones.
¿Pero cómo los ordenamos?
Alfabéticamente con la inicial del símbolo químico.
Alfabéticamente con la inicial del símbolo químico.
Podemos encontrarnos que los dos cationes sean diferentes.
Tenemos dos opciones para nombrarlos:
Nomenclatura de Stock
- (Cuántos oxígenos hay: tri, tetra...) + óxido de + X y X
Los ordenamos por el nombre de los elementos, no del símbolo químico.
Nomenclatura Sistemática
- (Cuántos oxígenos hay: tri, tetra...) + óxido de X + (-) + X
 |
| OXIDO DE HIERRO |