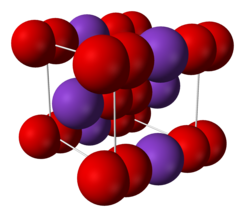
Los hidróxidos son compuestos iónicos formados por un metal (catión) y un elemento del grupo hidróxido (OH-) (anión). Se trata de compuestos ternarios aunque tanto su formulación y nomenclatura son idénticas a las de los compuestos binarios.
Formulación de los hidróxidos
Nomenclatura de los hidróxidos
Los hidróxidos son nombrados utilizando la nomenclatura tradicional, nomenclatura de stock así como la nomenclatura sistemática.
Nomenclatura tradicional: la nomenclatura tradicional comienza con la palabra hidróxido seguido del elemento teniendo en cuenta la valencia con la que actúa:
- Una valencia: Hidróxido ... ico
- Mg+2 + (OH)-1 » Mg(OH)2: hidróxido magnésico
- Dos valencias:
- Menor valencia: Hidróxido ... oso
- Pt+2 + (OH)-1 » Pt(OH)2: hidróxido platinoso
- Mayor valencia: Hidróxido ... ico
- Pt+4 + (OH)-1 » Pt(OH)4: hidróxido platínico
- Tres valencias:
- Menor valencia: Hidróxido hipo ... oso
- Zr+2 + (OH)-1 » Zr(OH)2: hidróxido hipocirconioso
- Valencia intermedia: Hidróxido ... oso
- Zr+3 + (OH)-1 » Zr(OH)3: hidróxido circonioso
- Mayor valencia: Hidróxido ... ico
- Zr+4 + (OH)-1 » Zr(OH)4: hidróxido circónico
- Cuatro valencias:
- Primera valencia (baja): Hidróxido hipo ... oso
- V+2 + (OH)-1 » V(OH)2: hidróxido hipovanadoso
- Segunda valencia: Hidróxido ... oso
- V+3 + (OH)-1 » V(OH)3: hidróxido vanadoso
- Tercera valencia: Hidróxido ... ico
- V+4 + (OH)-1 » V(OH)4: hidróxido vanádico
- Cuarta valencia (alta): Hidróxido per ... ico
- V+5 + (OH)-1 » V(OH)5: hidróxido pervanádico
Nomenclatura de stock: en la nomenclatura de stock comienza con la palabra hidróxido seguido del elemento metálico con la valencia del mismo en números romanos entre paréntesis.
Ejemplos:
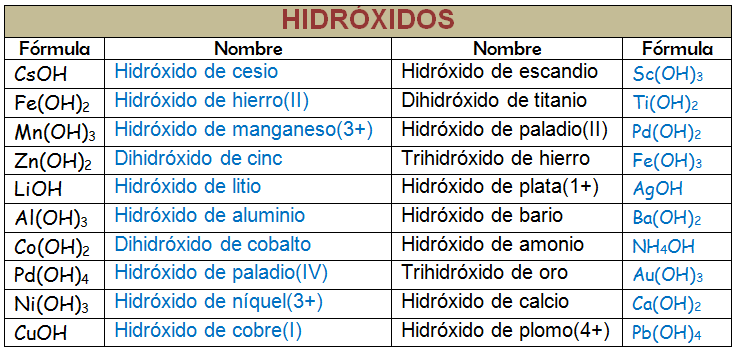
HgOH: hidróxido de mercurio (I)
Sn(OH)2: hidróxido de estaño (II)
Cuando el elemento metálico sólo tenga una valencia no se indica en numeros romanos la valencia:
Be(OH)2: hidróxido de berilio, en lugar de hidróxido de berilio (II)
CsOH hidróxido de cerio, en lugar de hidróxido de cerio (I)
Nomenclatura sistemática: en la nomenclatura sistemática se anteponen los prefijos numéricos a la palabra hidróxido.
Ejemplos:
Be(OH)2: dihidróxido de berilio
Sn(OH)4: tetrahidróxido de estaño
Fe(OH)3: trihidróxido de hierro
- Mg+2 + (OH)-1 » Mg(OH)2: hidróxido magnésico
- Menor valencia: Hidróxido ... oso
- Pt+2 + (OH)-1 » Pt(OH)2: hidróxido platinoso
- Mayor valencia: Hidróxido ... ico
- Pt+4 + (OH)-1 » Pt(OH)4: hidróxido platínico
- Menor valencia: Hidróxido hipo ... oso
- Zr+2 + (OH)-1 » Zr(OH)2: hidróxido hipocirconioso
- Valencia intermedia: Hidróxido ... oso
- Zr+3 + (OH)-1 » Zr(OH)3: hidróxido circonioso
- Mayor valencia: Hidróxido ... ico
- Zr+4 + (OH)-1 » Zr(OH)4: hidróxido circónico
- Primera valencia (baja): Hidróxido hipo ... oso
- V+2 + (OH)-1 » V(OH)2: hidróxido hipovanadoso
- Segunda valencia: Hidróxido ... oso
- V+3 + (OH)-1 » V(OH)3: hidróxido vanadoso
- Tercera valencia: Hidróxido ... ico
- V+4 + (OH)-1 » V(OH)4: hidróxido vanádico
- Cuarta valencia (alta): Hidróxido per ... ico
- V+5 + (OH)-1 » V(OH)5: hidróxido pervanádico
Sn(OH)2: hidróxido de estaño (II)
CsOH hidróxido de cerio, en lugar de hidróxido de cerio (I)
Sn(OH)4: tetrahidróxido de estaño
Fe(OH)3: trihidróxido de hierro